鞠振宇/陈畅团队合作揭示蛋白质亚硝基化修饰调控造血干细胞再生新机制
暨南大学衰老与再生医学研究院鞠振宇研究组与中国科学院生物物理研究所陈畅研究组合作共同揭示了蛋白质亚硝基化修饰对自我更新时期的造血干细胞蛋白稳态及存活新的调控机制。北京时间2021年3月30日,国际学术期刊《细胞报告》在线发表了这一研究成果。
造血干细胞(Hematopoietic stem cell, HSC)是血液系统中的成体干细胞,具有长期自我更新的能力和分化成多种成熟血细胞的卓越能力。化疗和放疗等常见的癌症治疗方法在杀死癌细胞的同时损伤造血干细胞,影响血液再生和病人的免疫系统。在各种应激情况特别是骨髓移植或者化疗诱导的骨髓消融的情况下,造血干细胞的再生能力对于造血系统的补充至关重要。为了维持造血干细胞的长期造血重建能力,大部分的造血干细胞处在静止状态,栖息在低氧的环境中。然而,在增殖及自我更新的压力下,氧化应激和硝化应激对HSC再生中的调控机制尚不清楚。
在鞠振宇研究员和陈畅研究员的指导下,两组研究人员共同揭示了蛋白质亚硝基化修饰对自我更新时期的造血干细胞蛋白稳态及存活的调控机制,证明了蛋白质巯基去亚硝基化关键酶GSNOR (S-nitroglutathione reductase)介导的蛋白亚硝基化修饰与Chop介导的未折叠蛋白反应在造血干细胞再生过程中调节HSC活性之间的机制联系。这一发现强调了在增殖应激下适当调节HSC蛋白稳态的重要性,而蛋白质硝基化修饰的干预可能有助于实现HSC的功能扩展。
研究人员首先发现,增殖压力下造血干细胞中NO及整体蛋白巯基亚硝基化修饰SNO的水平明显升高,同时伴随着大量蛋白聚集的累积,该结果提示NO及SNO对增殖压力下造血干细胞具有一定的调控作用。研究人员利用调控蛋白质巯基去亚硝基化关键酶GSNOR敲除的小鼠进一步发现,敲除GSNOR对于稳态情况下的造血系统表型没有显著影响。但是,在增殖压力下,敲除GSNOR的小鼠HSC造血重建能力下降,自我更新能力减弱。接下来研究人员通过亚硝基化修饰蛋白组学联用质谱,流式细胞术等方法发现敲除GSNOR的HSC中NO及整体SNO水平明显升高,同时细胞聚集体的累积及细胞凋亡显著增加。为了证明过度激活的NO信号通路诱导GSNOR敲除小鼠HSC重构缺陷的假设,研究人员用NO的抑制剂L-NAME处理,发现GSNOR敲除小鼠的造血重建能力及自我更新能力均明显增强。同时,给予帮助蛋白折叠的分子伴侣TCA处理及在GSNOR敲除小鼠中同时敲除诱导凋亡的Chop基因,均能明显改善GSNOR敲除小鼠的造血重建能力。
作为一种翻译后修饰,蛋白质巯基亚硝基修饰是信号转导途径的重要介体。异常巯基亚硝基化修饰通常会影响蛋白质错误折叠并导致内质网应激,从而导致细胞功能受损。该研究显示再生应激下HSC中蛋白质巯基亚硝基化和蛋白质聚集水平增加,这加强了蛋白质巯基亚硝基化增加与蛋白质折叠受损之间的关系。在该研究中,敲除GSNOR细胞中,一些热休克蛋白HSP60、HSP70和HSP90(蛋白质折叠所需的重要伴侣)巯基亚硝基化修饰水平显著增加。接下来,研究测定了热休克蛋白90(HSP90)的巯基亚硝基化及其在蛋白质聚集中的作用。该研究报道了HSP90在GSNOR敲除细胞中的M结构域(Cys521/590/591)新的巯基亚硝基化残基修饰并证明它可以影响HSP90的蛋白质折叠功能,引起蛋白质聚集。通过突变HSP90的亚硝基化残基逆转巯基亚硝基化修饰可以显著改善GSNOR敲除引起的蛋白质聚集。该研究发现HSP90的巯基亚硝基化修饰损害了其蛋白质折叠活性,导致应激时GSNOR敲除细胞中蛋白质聚集的累积。鉴于GSNOR缺乏可以通过增加许多蛋白质的巯基亚硝基化修饰诱导蛋白质聚集,后续确定GSNOR调节未折叠蛋白质反应的其他重要靶点也非常有意义。
这项研究解释了在调节HSC再生过程中GSNOR介导的蛋白巯基亚硝基化和Chop介导的未折叠蛋白反应之间重要机制联系。该研究强调了HSC蛋白稳态调节在生理情况以及增殖应激下维持HSC应激活性的重要性。同时,在增殖压力下,蛋白亚硝基化修饰调控可能有助于实现HSC功能扩增,并且不会影响其存活。这项研究为造血干细胞再生的调控提供了新的理论基础。
暨南大学衰老与再生医学研究院鞠振宇教授、中国科学院生物物理研究所陈畅教授和暨南大学衰老与再生医学研究院陈陟阳教授、刘波副教授为该文共同通讯作者,博士生易微微、张玉英、副教授刘波为共同第一作者。该研究获得国家重点研发计划、中国科学院战略性先导科技项目(B类)、国家自然科学基金重大研究计划的资助。

GSNOR调控增殖压力下造血干细胞中蛋白亚硝基化(SNO)与NO的平衡。倒影中当鸟在桩上的时候,木桩保持平衡,鸟飞走后,木桩出现失衡。鸟代表GSNOR,木桩的平衡是NO和SNO。
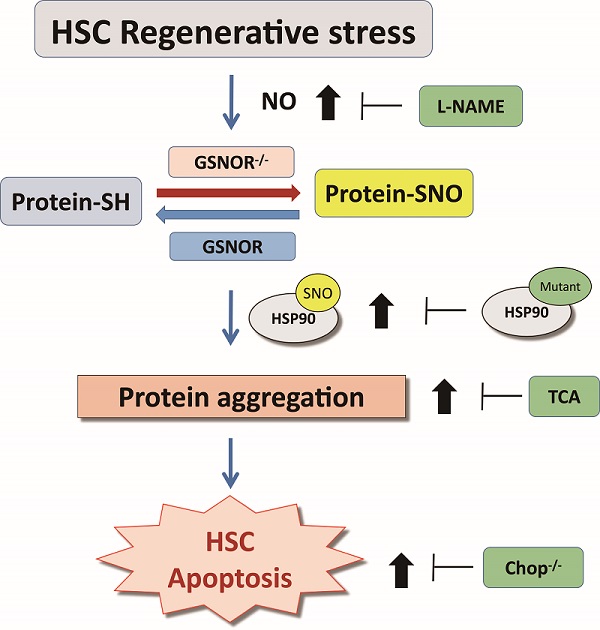
图文摘要